
Parfois, des détails apparemment insignifiants ont un impact incroyable sur l'image globale. Ce principe s'applique à de nombreux domaines de notre vie: le sourire mystérieux de Mona Lisa, qui a donné lieu à de nombreuses théories et spéculations; une ligne de code qui peut complètement changer la fonctionnalité du programme; l'ordre d'arrangement des atomes, qui modifie les propriétés d'une substance. Nous parlerons de ce dernier aujourd'hui. Des scientifiques de l'Université de Tsukuba (Japon) ont avancé une théorie selon laquelle il est possible de créer une nouvelle structure de diamant qui sera plus dure que le minéral connu. Les scientifiques ont nommé leur création "penta diamant". Que faut-il pour créer un diamant penta, quelles propriétés peut-il posséder et où peut-on utiliser une substance aussi inhabituelle? Nous trouverons des réponses à ces questions dans le rapport des scientifiques. Aller.
Base d'étude
Le carbone est un élément omniprésent dans le tableau périodique et est la base d'une grande variété de composés organiques et inorganiques. Dans la nature, on trouve du carbone presque partout: huile et tourbe, méthane et dioxyde de carbone, muscles et os, etc. etc. En bref, le carbone est considéré comme l'un des principaux éléments constitutifs de la vie sur Terre pour une raison.
Certaines substances ou éléments chimiques peuvent exister sous différentes formes et dans des conditions différentes. C'est ce qu'on appelle l'allotropie. Carbon est le détenteur du record dans ce secteur, car il a plus de 9 modifications allotropiques.
Les raisons de la présence d'un si grand nombre d'allotropes de carbone sont l'hybridation orbitale, les conditions aux limites et les défauts topologiques. Trois formes d'hybridation orbitale (sp, sp 2 et sp 3) représentent des allotropes couvrant toutes les dimensions:
- chaînes unidimensionnelles pour sp (polyyne);
- feuille bidimensionnelle pour sp 2 (graphène);
- Maillage 3D pour sp 3 (losange).
De plus, les conditions aux limites et les défauts topologiques permettent au carbone de former des allotropes supplémentaires avec des morphologies uniques: par exemple, le fullerène et les nanotubes de carbone, qui ont des propriétés électroniques et structurelles inhabituelles.
Une variété de fullerènes.
Les allotropes de carbone, constitués d' atomes sp 2 et sp 3 C, attirent l'attention des chercheurs en raison de leur diversité morphologique, qui est due au grand nombre de combinaisons d' atomes sp 2 et sp 3 au sein d'un même système. Les fullerènes traités avec une pression et une température élevées (par exemple, C 60), qui peut avoir une faible densité de masse en raison de liaisons covalentes entre les fullerènes et les pores nanométriques.
De plus, il existe des études décrivant la trempe rapide du carbone amorphe, qui conduit à la formation d'un allotrope hybride sp 2 -sp 3 -Q -carbon, qui a un magnétisme et une dureté supérieurs au diamant.
Le carbone peut être grossièrement appelé pâte à modeler entre les mains des scientifiques, car il peut être utilisé pour créer de nombreuses substances de propriétés et de fonctionnalités différentes, il y aurait du désir et de l'imagination.
Dans ce travail, les scientifiques ont présenté une étude théorique d'un allotrope de carbone tridimensionnel, composé d'atomes C sp 2 et sp 3(diamant penta). Il peut être obtenu par copolymérisation de molécules d'hydrocarbures contenant des cycles pentagonaux (spiro [2.4] heptane-4,6-diène (C 7 H 8 ) et [5.5.5.5] -phénestran-tétraine).
Le diamant Penta est constitué d'anneaux pentagonaux de groupe spatial Fm¯3m en raison de la copolymérisation de ces molécules constitutives. Des calculs ont montré que le diamant penta a un module de volume élevé * - 381 GPa, ce qui représente environ 80% du diamant. Cela suggère que le diamant penta est un allotrope de carbone solide.
De plus, il présente un coefficient de Poisson * (-0,241) négatif, ce qui conduit à un module de Young * (1691 GPa) et un module de cisaillement * extrêmement élevés . (1113 GPa), ce qui est supérieur à celui du diamant ou d'autres carbones ultra-forts.
Module d'élasticité en vrac * - une caractéristique de la capacité d'une substance à résister à une compression complète.
Coefficient de Poisson * - le rapport de la compression latérale relative à la tension longitudinale relative.
Module de Young * (module d'élasticité) - une évaluation de la capacité d'un matériau à résister à la tension, à la compression sous déformation élastique.
Module de cisaillement * - une évaluation de la capacité du matériau à résister à la déformation par cisaillement.Le diamant Penta est un semi-conducteur avec une bande interdite indirecte * de 2,25 eV, qui devrait avoir une mobilité de trou élevée * .
* — , .
* — .
Tous les calculs ont été effectués sur la base de la théorie fonctionnelle de la densité implémentée dans le progiciel STATE ( STF-ElectronMo ).
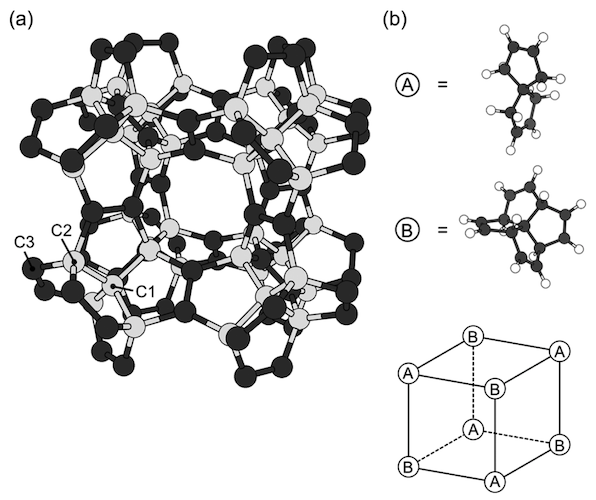
Image # 1
Les schémas ci-dessus montrent la géométrie optimisée d'un pentagone avec un paramètre de réseau de 9,195 Å et un groupe d'espace Fm¯3m. Le réseau covalent est constitué exclusivement de pentagones, dans lesquels trois des cinq arêtes sont séparées par des pentagones voisins ( 1a ), en raison de la copolymérisation de C 7 H 8 et de [5.5.5.5] -phénestran-tétrain, qui sont alternativement situés aux sommets du réseau cubique ( 1b ).
Selon ces molécules constitutives et leur disposition, la maille élémentaire d'un diamant peta contient 22 atomes de carbone: 10 sont sp3 et 12 - par des atomes de sp 2 . De plus, les opérateurs de symétrie appartenant au groupe Fm¯3m réduisent le nombre de régions atomiques indépendantes à trois.
Puisque le réseau est composé d'atomes de carbone sp 2 (triple coordonné) et sp 3 (quadruple coordonné), les liaisons covalentes sont classées en deux groupes. Les longueurs de liaison calculées liées aux atomes sp 3 sont de 1,563 Â pour les liaisons C1-C1 et de 1,520 Â pour C2-C3. Mais la longueur de liaison (C3-C3) pour les atomes sp 2 est de 1,349 Å, ce qui confirme la présence d'une double liaison dans les atomes sp 2 .
Comme indiqué en 1a, le diamant penta a de grands "pores" cubiques avec des bords de 3,664 Å, entourés d'un réseau covalent pentagonal. Par conséquent, il présente une faible masse volumique avec une densité de 2,26 g / cm 3 , comme le graphite, mais 36% de moins que le diamant.
L'énergie totale relative d'un diamant penta est de 275 meV / atome, ce qui correspond à un diamant classique. Mais l'énergie totale est supérieure à celle du diamant, du graphite et d'autres matériaux de carbone dur, bien que inférieure à celle du C60, qui est connu pour être un allotrope de carbone métastable à espace nul. L'énergie totale modérée s'explique par la distorsion structurelle des angles de liaison pour les atomes sp 2 et sp 3 .
Concernant les atomes de sp 3 : malgré le fait que l'atome C1 a un sp presque parfait3 hybridation avec un angle de liaison θ212 = 109,4 °, l'atome C2 a des angles de liaison θ212 = 115,9 ° et θ323 = 101,9 °, qui sont plus larges et plus étroits que les angles de liaison correspondants de sp 3 idéal . Concernant les atomes de sp 2 : en raison du réseau pentagonal, l'angle de liaison lié à C3 est θ232 = 133,4 ° et θ233 = 113,3 °, ce qui est également plus grand et plus petit que les angles de liaison correspondants pour un sp 2 idéal .
Une énergie modérée augmente également l'énergie de formation (ΔE) du penta diamant lors de la copolymérisation directe de C 7 H 8 et de [5.5.5.5] -phénestran-tétraine:
spironadien + fenestratétraène = diamant penta + 12H 2 + ΔEL'énergie de formation calculée est de 0,31 eV / atome, reflétant la consommation d'énergie pour la formation d'un réseau covalent d' atomes de carbone sp 2 et sp 3 avec des angles de liaison déformés.
Ainsi, on s'attend à ce que le penta diamant soit synthétisé en utilisant la réaction d'Ullmann pour le bromospiro [4.4] nona-2,7-diène et le brome [5.5.5.5] -phénestratétraène au lieu de leur forme primaire.
Ensuite, nous avons étudié la stabilité thermique du penta diamant en simulant la dynamique moléculaire à une température de 4000 K. Afin de comprendre quels changements structurels peuvent se produire, des calculs de dynamique moléculaire ont été effectués avec une température constante pour une cellule atomique expansée (88 atomes de carbone) pendant 12 ps (picosecondes, 1 ps = 10-12 s) et pour un simplifié (1x1x1) pour 146 ps.
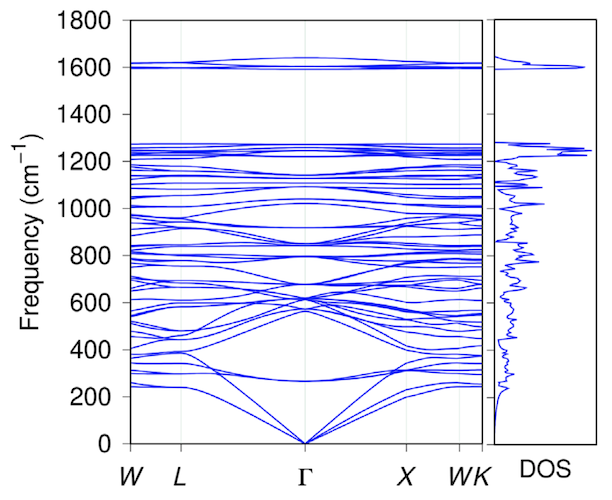
Image # 2
Selon les résultats de la simulation après 14 ps à 4000 K, le diamant penta conserve entièrement sa topologie d'origine à la fois dans la cellule atomique complexe et simplifiée (graphique ci-dessus).
Par conséquent, le diamant penta est thermiquement et énergétiquement stable s'il est synthétisé en utilisant les schémas appropriés proposés dans ce travail.
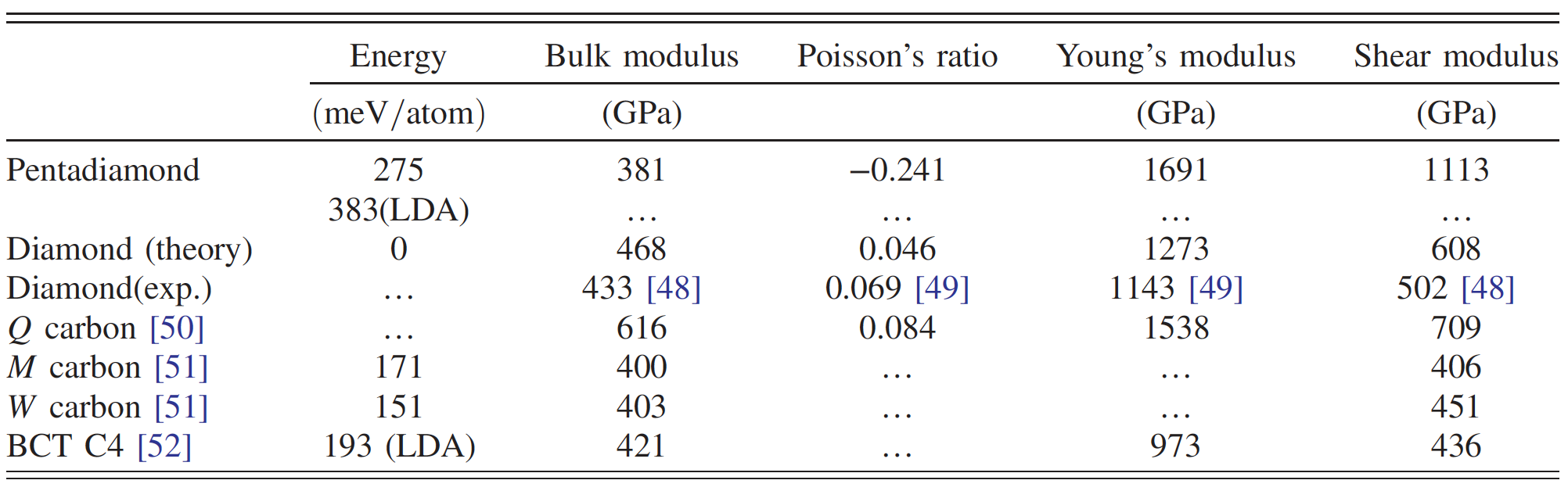
Comparaison des propriétés du penta diamant et d'autres allotropes de carbone.
Les propriétés mécaniques du diamant penta ont été étudiées au moyen de constantes élastiques cij, qui sont déterminées en évaluant la différence finie d'énergie totale par rapport aux déformations. Les valeurs calculées des constantes élastiques étaient: 1715,3 GPa pour s 11 (= s 22 = s 33 ); −283,5 GPa pour s12 (= s 13 = s 23 ) et 1187,5 GPa pour s 44 (= s 55 = s 66 ).
Il convient également de noter que ces indicateurs satisfont pleinement au critère de stabilité de Born (avec 11 - avec 12 > 0, avec 11 + 2c 12 > 0 et avec 44 > 0), ce qui indique en outre la stabilité du penta diamant.
Dans le cas de la symétrie cubique, le module d'élasticité en vrac est calculé par la formule: B = (s 11 + 2s 12) / 3. En conséquence, B était égal à 381 GPa, soit plus de 80% du chiffre correspondant pour le diamant. Cela suggère que le diamant penta est un candidat potentiel pour les allotropes solides de carbone, bien que sa densité soit assez faible (comme celle du graphite).
Pour une étude plus approfondie des propriétés mécaniques, le module de Young du penta-diamant a été calculé à l'aide de la formule:
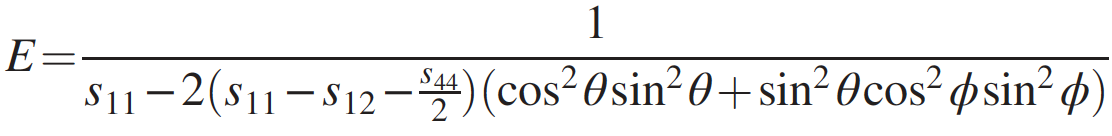
où θ et ϕ sont les angles d'Euler * , s ij est la conformité élastique déterminée par cij avec les relations entre s 11 = [c 11 + c 12 ] / [(c 11 - c 12 ) (c 11 + 2c 12 )], s 12 = [-c 12 ] / [(c 11- c 12 ) (c 11 + 2c 12 )] et s 44 = 1 / c 44 .
Angles d'Euler * - angles décrivant la rotation d'un corps absolument rigide dans un espace tridimensionnel.
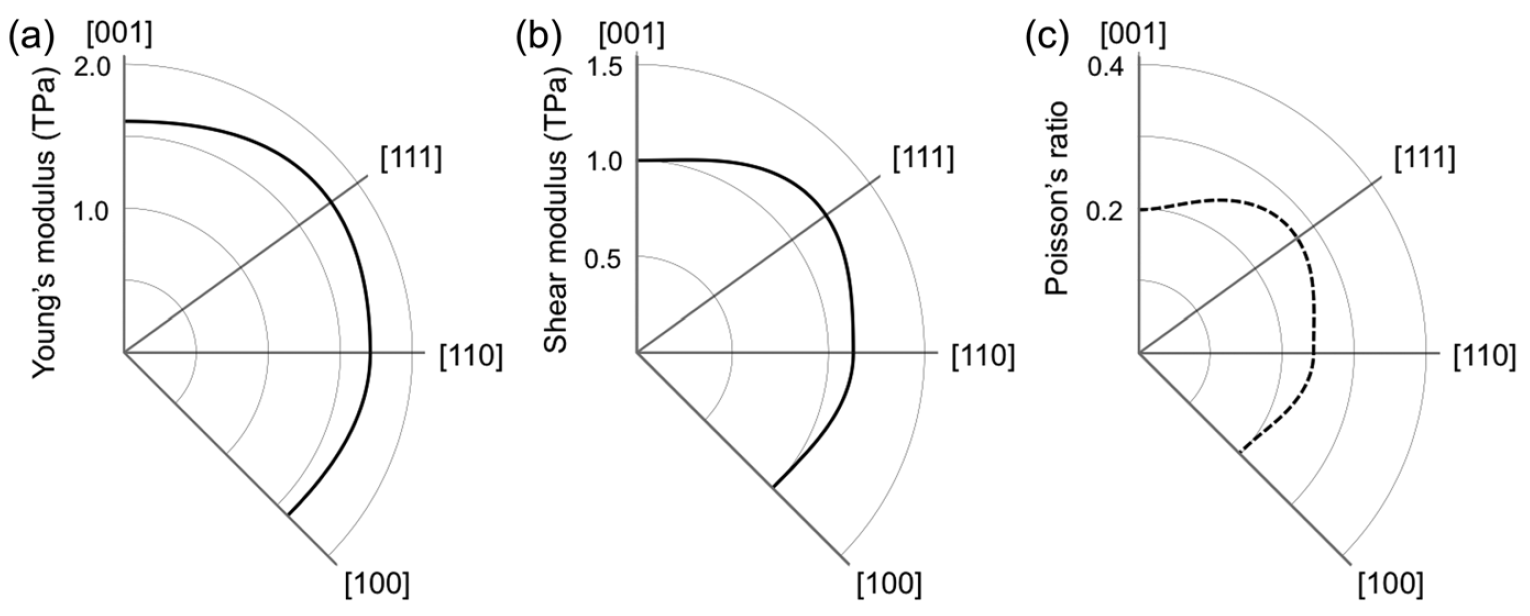
Image n ° 3
Le module de Young du diamant penta est extrêmement élevé et dépasse 1,5 TPa dans toutes les directions ( 3a ). Connaissant le module de Young et le module d'élasticité en vrac, il est possible de calculer le module de cisaillement ( 3b ), qui s'est également avéré assez élevé (1 TPa) dans toutes les directions.
Par conséquent, le diamant penta peut présenter une rigidité extrême par rapport aux déformations structurelles anisotropes. Le fait que le module de Young et le module de cisaillement soient plus élevés que ceux des autres allotropes de carbone dur et extra-dur (tableau ci-dessus) nécessite également une attention particulière.
Ces valeurs élevées des modules décrits ci-dessus indiquent que le penta diamant doit avoir un coefficient de Poisson négatif. Cette affirmation a été confirmée par des calculs montrant un coefficient de Poisson compris entre -0,20 et -0,28, selon les directions du réseau ( 3c ). Ces indicateurs uniques conduisent au fait que la vitesse du son dans le diamant penta sera également assez élevée (28700 m / s contre 12000-18350 m / s pour le diamant ordinaire).
Image n ° 4
Le graphique ci-dessus montre la structure électronique et la densité des états du penta diamant, qui est un semi-conducteur avec une bande interdite indirecte de 2,52 eV. Les bandes de valence et de conduction sont situées aux points L et X, respectivement. La branche la plus élevée de la bande de valence et la branche la plus basse de la bande de conduction ont une dispersion significative (1 eV ou plus).
Par conséquent, on s'attend à ce que le penta diamant ait de petites masses efficaces aux bords des bandes: les masses calculées d'électrons au point X sont de 0,98 et 0,67 (inférieures à celle du diamant) dans les directions vers les points Γ et W, respectivement. Mais la situation par rapport au bord de la bande de valence est inverse: les masses calculées des trous au point L sont respectivement de 1,59 et 0,76 (supérieures à celle du diamant) selon les directions vers les points W et Γ.
La masse modérée du porteur et la densité élevée des états aux bords de la bande suggèrent que le diamant penta peut avoir une mobilité modérée du porteur à la fois pour un électron et un trou. La relation de dispersion ainsi que la densité d'état montrent que le penta diamant a une structure électronique volumétrique tridimensionnelle, comme un diamant, qui reflète son réseau covalent tridimensionnel avec une symétrie élevée.
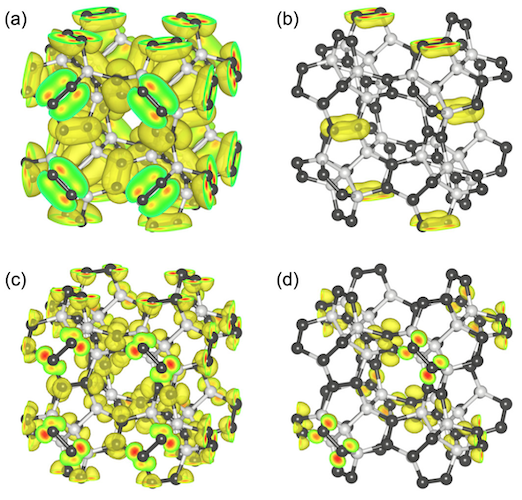
Image №5
Pour une meilleure compréhension de la structure électronique du diamant penta, les scientifiques ont mené une étude de la fonction d'onde de la branche la plus élevée et de la branche la plus basse du diamant penta à certains points de symétrie.
Les fonctions d'onde de la branche supérieure de la bande de valence aux points L et Γ sont réparties sur les atomes C3, qui ont le caractère d'une liaison π, en raison de leur sp 2-hybridation. La fonction d'onde de la branche inférieure de la bande de conduction aux points Γ et X est également répartie sur les atomes de C3 avec une π-nature anti-liante. Les scientifiques notent que l'état de valence et l'état de conduction ne sont pas un état π pur, mais des états hybrides contenant une petite quantité de la composante σ. Cela signifie que les états électroniques proches et autour des bords de bande sont considérés comme des états électroniques π de dimères sp 2 C, qui sont distants d'environ 2,6 Â de ses huit régions adjacentes.
Pour une connaissance plus détaillée des nuances de l'étude, je vous recommande de vous pencher sur le rapport des scientifiques .
Épilogue
Dans cette étude, les scientifiques ont avancé la théorie selon laquelle il est possible de créer une structure de carbone avec de meilleures propriétés que le diamant. Les calculs effectués au cours de l'étude ont confirmé cette conjecture.
Par copolymérisation du spiro [2.4] heptane-4,6-diène (C 7 H 8 ) et du [5.5.5.5] -phénestrane-tétrain avec une symétrie Fm¯3m, un réseau pentagonal covalent tridimensionnel d'atomes de carbone sp 2 et sp 3 peut être synthétisé . Les scientifiques ont appelé leur création un diamant penta.
La plupart des propriétés mécaniques du diamant penta sont supérieures à celles du diamant conventionnel que nous connaissons ou d'autres allotropes de carbone dur. Curieusement, le diamant penta est plus dur que le diamant, mais sa densité est similaire à celle du graphite.
À l'avenir, les scientifiques ont l'intention de traduire la théorie en pratique. Mais même maintenant, leur travail démontre clairement que les possibilités de la science moderne sont vraiment infinies, si, bien sûr, vous prêtez attention aux détails, rappelez-vous toutes les nuances des lois de la nature et n'ayez pas peur d'expérimenter.
Vendredi off-top:
BBC , . ( , )
BBC , . ( , )
Off-top 2.0:
, , ? , , .. - …
, , ? , , .. - …
Merci pour votre attention, restez curieux et passez un super week-end les gars! :)
Un peu de publicité
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir du contenu plus intéressant? Soutenez-nous en passant une commande ou en recommandant à des amis, VPS cloud pour les développeurs à partir de 4,99 $ , un analogue unique des serveurs d'entrée de gamme, qui a été inventé par nous pour vous: Toute la vérité sur VPS (KVM) E5-2697 v3 (6 cœurs) 10 Go DDR4 480 Go SSD 1 Gbps à partir de 19 $ ou comment diviser le serveur correctement? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
Dell R730xd 2 fois moins cher au centre de données Equinix Tier IV à Amsterdam? Nous avons seulement 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV à partir de 199 $ aux Pays-Bas!Dell R420 - 2x E5-2430 2,2 Ghz 6C 128 Go DDR3 2x960 Go SSD 1 Gbps 100 To - à partir de 99 $! Lisez à propos de Comment construire l'infrastructure de bldg. classe avec l'utilisation de serveurs Dell R730xd E5-2650 v4 coûtant 9000 euros pour un sou?