
La vie humaine selon les normes de l'Univers n'est qu'un instant, mais selon les normes d'un fly-by-night, c'est une éternité. Pour nous, l'évaluation de la durée de notre propre chemin de vie est compliquée par les événements qui se produisent dans le processus, les personnes que nous rencontrons et avec lesquelles nous nous séparons, les émotions que nous ressentons. Après tout, plus le cerveau d'une créature est complexe, plus sa conscience de soi est complexe. Cependant, tout chemin est déterminé non seulement par sa richesse, mais aussi par le fait que tôt ou tard il se termine. Pendant de nombreux siècles, les gens ont essayé de répondre à la question de savoir ce qui se trouve au-delà des limites de la vie, et personne n'a de réponse catégorique claire. Néanmoins, «avant» n'est pas moins mystérieux et mystérieux que «après». Des scientifiques de l'American Museum of Natural History (New York, USA) ont mené une étude,qui décrit une variante possible de l'origine des molécules organiques il y a des milliards d'années. Qu'est-ce qui aurait pu être le début de la vie sur la planète, là où cela s'est passé, et comment cette connaissance peut-elle aider à comprendre notre monde ici et maintenant? Les réponses à ces questions sont cachées dans le rapport des scientifiques. Aller.
Base de recherche
Comme mentionné précédemment, on ne sait pas avec certitude ce qui attend une personne ou tout autre organisme vivant après que son corps ait perdu sa vitalité. Cette question est posée par des physiciens, des biologistes, des théologiens et des philosophes. Ils ont tous des réponses, chacune ayant le droit d'exister, mais ce ne sont que des théories qui n'ont pas encore été confirmées empiriquement pour des raisons évidentes.
Quant à ce qui s'est passé avant que tout ne commence, cette question est tout aussi complexe et controversée. La théorie du big bang nous a donné l'idée de l'origine de l'univers, mais des questions subsistent sur ce qui l'a précédé. La théorie évolutionniste de Darwin a aidé à comprendre comment les espèces de notre planète sont interconnectées, comment elles ont évolué, comment l'une s'est transformée en une autre. Mais même ici, des questions se posent: quoi ou qui était le premier, pourquoi la vie est née, dans quelles circonstances, cet événement était-il par hasard ou était-ce le grand plan de quelqu'un. Des questions pendant des siècles, pas autrement.
Néanmoins, les connaissances possédées par l'homme moderne peuvent servir d'outil pour construire la chaîne d'événements qui ont conduit à la naissance de la vie. Nous savons que l'hydrogène, l'azote et l'oxygène sont des éléments fondamentaux dans l'origine et le maintien de la vie. Dans la vie moderne, la plupart des molécules organiques sont formées par la réduction du dioxyde de carbone (CO 2 ) par plusieurs voies de «fixation du carbone» (par exemple, la photosynthèse chez les plantes). Mais la plupart de ces voies nécessitent soit l'énergie de la cellule, soit elles sont apparues relativement tard. La question se pose - que s'est-il passé avant?
Selon les scientifiques, l'un des moyens de formation de matière organique pourrait être la réduction du CO 2 à l'aide de H 2 . Des études géologiques montrent que le CO2 a été trouvé à des concentrations relativement élevées dans l'océan pendant la Catarche * , tandis que H 2 était le produit de multiples processus dans la croûte terrestre et était libéré vers l'extérieur par les évents hydrothermaux.
Katarchei * est un éon géologique (période de temps) qui a duré les 600 premiers millions d'années d'existence de la Terre.Par conséquent, à la jonction de deux environnements (l'océan et la croûte terrestre), une réaction s'est produite entre deux gaz dissous, qui a conduit à la formation d'hydrocarbures, qui ont ensuite joué un rôle important dans le passage de la géochimie à la biochimie.
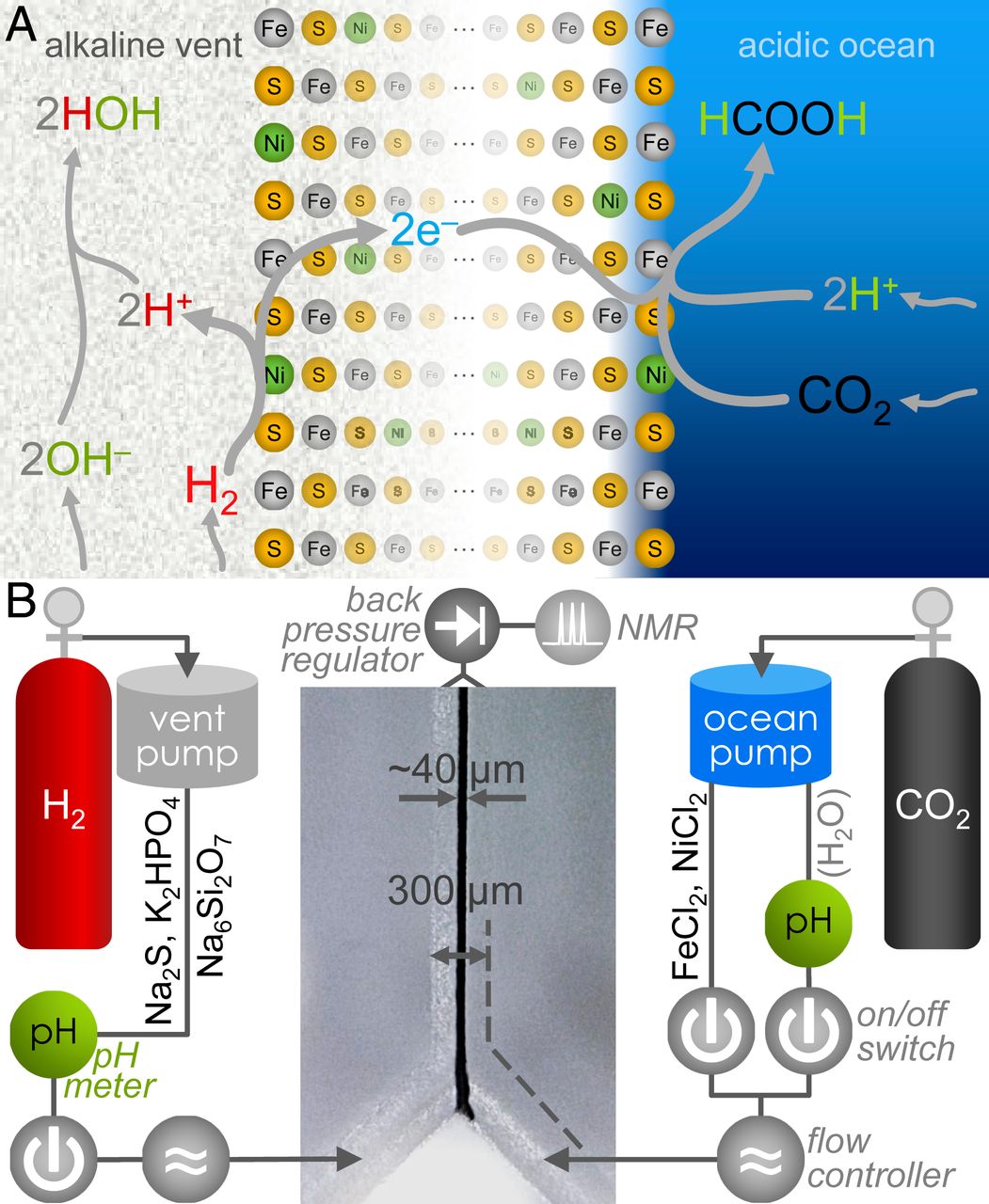
Image №1
Dans des conditions standard (1 à, 25 ° C, pH 7), la réaction entre CO 2 et H 2 avec formation de formiate (HCOO - ) est thermodynamiquement défavorable avec ΔG 0 ' = + 3,5 kJ / mol. Cependant, dans les sources alcalines anciennes ( 1A ), H 2 est présent en OH - riches eaux d'une source hydrothermale, ce qui a contribué à son oxydation dans l' eau. De plus, le CO 2serait dissous dans un océan relativement acide, ce qui a facilité la protonation dans sa réduction en HCOO - .
Avec l'aide de minéraux Fe (Ni) S déposés à l'interface entre l'océan et la croûte, un gradient de pH de plus de trois unités aurait dû être suffisant pour augmenter la viabilité de la réaction d'environ 180 mV, ce qui la rend favorable à la formation organique.
Une fois formé, le formiate aurait un potentiel chimique abiotique suffisant. Par exemple, il est connu que les groupes formyle forment des composés intermédiaires du cycle réducteur des acides tricarboxyliques * et de la voie réductrice de l'acétyl-CoA * , suggérant une voie possible pour le développement du métabolisme biologique.
* — .
- ( - WL-)* — , 2 .Une autre théorie suggère que lorsqu'il est chauffé en présence d'ammoniac, qui est également un composant putatif des eaux alcalines, le formiate forme le formamide [HC (O) NH 2 ], une molécule hautement réactive qui est la pierre angulaire de l'une des théories de l'origine de la vie ( Formamide et l'origine de la vie ). La réaction ultérieure de ce mélange donne du cyanure d'hydrogène (HCN), qui est également la base d'une autre théorie de la formation de matière organique ( Origines communes de l'ARN, des précurseurs de protéines et de lipides dans un protométabolisme cyanosulfidique ). À son tour, la déshydratation du formiate conduit à la formation de monoxyde de carbone (CO) ( acide acétique activé par fixation de carbone sur (Fe, Ni) S dans des conditions primordiales.). Comme vous pouvez le voir, il existe de nombreuses théories sur l'origine des composés organiques, et chacune d'elles a des explications assez logiques.
Bien qu'il y ait eu plusieurs sources de carbone réduit sur la Terre primitive et de nombreux environnements possibles pour des produits chimiques riches, le scénario hydrothermal alcalin décrit ci-dessus est beaucoup plus intéressant pour les scientifiques en raison de sa similitude avec la méthode WL de fixation du carbone.
Un argument supplémentaire en faveur de l'importance potentielle du scénario hydrothermal alcalin pour la formation de matière organique est le fait que le processus WL est la seule des six voies biologiques connues pour la fixation du carbone qui libère de l'énergie en général, plutôt que de la consommer, et ses variations sont présentes chez les représentants existants des deux archées ( méthanogènes *) et les bactéries ( acétogènes * ).
Les méthanogènes * sont des archées qui forment du méthane comme sous-produit du métabolisme dans des conditions anoxiques.
Les acétogènes * sont des bactéries qui libèrent de l'acétate (CH 3 COO - ) comme produit final de la respiration anaérobie ou de la fermentation homoacétate.La première étape dans ce sens est la réduction du CO 2 avec H 2 pour former du formiate (HCOO - ou son équivalent électronique déshydraté, c'est-à-dire CO).
Cette réaction est endergonique * , de sorte que certains membres des archées et des bactéries utilisent soit la bifurcation électronique * soit la chimiosmose * à travers la membrane cellulaire pour déclencher ce processus.
Réactions endergoniques * - réactions chimiques qui nécessitent de l'énergie de l'extérieur pour leur déroulement.
Bifurcation électronique * - le mécanisme de séparation des électrons dans une réaction redox.
Chimiosmos * - transformation de l'énergie de la chaîne de transport d'électrons en énergie de l'ATP (adénosine triphosphate).Cependant, en l'absence de mécanismes de fusion cellulaire tels que la bifurcation électronique ou la chimiosmose, cette première étape endergonique est un goulot d'étranglement énergétique clé dans la voie WL et reste une question ouverte majeure dans les études sur l'origine de la fixation biologique du carbone.
Dans cette étude, les chercheurs ont démontré une réduction indirecte abiotique du CO 2 en HCOO - en utilisant un gradient de pH induit par H 2 dans les sédiments microfluidiques Fe (Ni) S, grâce à un mécanisme qui ressemble à un chemin d'écoulement séparé des électrons WL.
Résultats de recherche
Tout d'abord, un équivalent laboratoire d'un milieu hydrothermal alcalin a été préparé avec une simulation de l'interface entre la croûte terrestre et les eaux océaniques. Le composant alcalin comprend Na 2 S (100 mM), K 2 HPO 4 (10 mM) et Na 2 Si 3 O 7 (10 mM) dans de l' eau désaérée. L'analogue océanique comprenait FeCl 2 (50 mM) et NiCl 2 (5 mM). Les deux fluides ont été introduits dans un réacteur microfluidique de borosilicate en forme de Y ( 1B ).
La pression ambiante de H 2 et CO 2 était insuffisante pour réduire les émissions de CO 2donc, au lieu d'essayer de dissoudre tout gaz par bullage * avant la réaction, il a été décidé d'utiliser des pompes microfluidiques fonctionnant à la pression du gaz.
Bulles (bullage) * - processus de passage d'un gaz à travers une couche de liquide.Le liquide alcalin a été expulsé par H 2 à une pression de 1,5 bar, et l'analogue océanique a été poussé par du CO 2 à la même pression.
Chaque cycle du réacteur a été divisé en deux étapes successives: premièrement, pour le dépôt des dépôts de Fe (Ni) S à la jonction (à l'interface) de deux liquides; le second («post-précipitation») - pour essayer de créer une réaction entre CO 2 et H 2 (ou d'autres réactifs).
À la suite de l'interaction d'un liquide alcalin et d'un analogue océanique pendant 15 à 60 secondes au stade de la précipitation, un sédiment d'une largeur de 30 à 60 μm s'est formé à l'interface entre deux liquides, visible au microscope optique numérique (au centre en 1B). L'élimination des métaux du côté analogique de l'océan après les précipitations a empêché une augmentation des sédiments jusqu'à la valeur critique de la fermeture du canal du réacteur.
Après la formation de sédiments et pour éviter le colmatage des canaux microfluidiques par une sédimentation supplémentaire dans la deuxième étape, le fluide océanique a été commuté pour nettoyer de l'eau désaérée déplacée par le CO 2 (à droite en 1B ). Dans ce cas, l'analogue du liquide alcalin est resté le même avec Na 2 S, K 2 HPO 4 et Na 2 Si 3 O 7 poussés par H 2 .
Ensuite, le niveau de pH des liquides entrants au point d'entrée a été déterminé: l'analogue de l'océan - pH 3,9, eaux alcalines - pH 12,3. À un débit de 5 μL / min pour chaque entrée, le temps de séjour des liquides dans le canal central était d'environ 3,3 s, de sorte que le système a pu fonctionner pendant au moins 2 minutes avant de collecter les données de sortie. Ensuite, la sortie totale du réacteur (mélange de liquides) a été collectée et analysée par spectroscopie RMN. L'analyse a montré que la valeur moyenne de la concentration de HCOO - était de 1,5 μM.

Tableau 1: résultats expérimentaux.
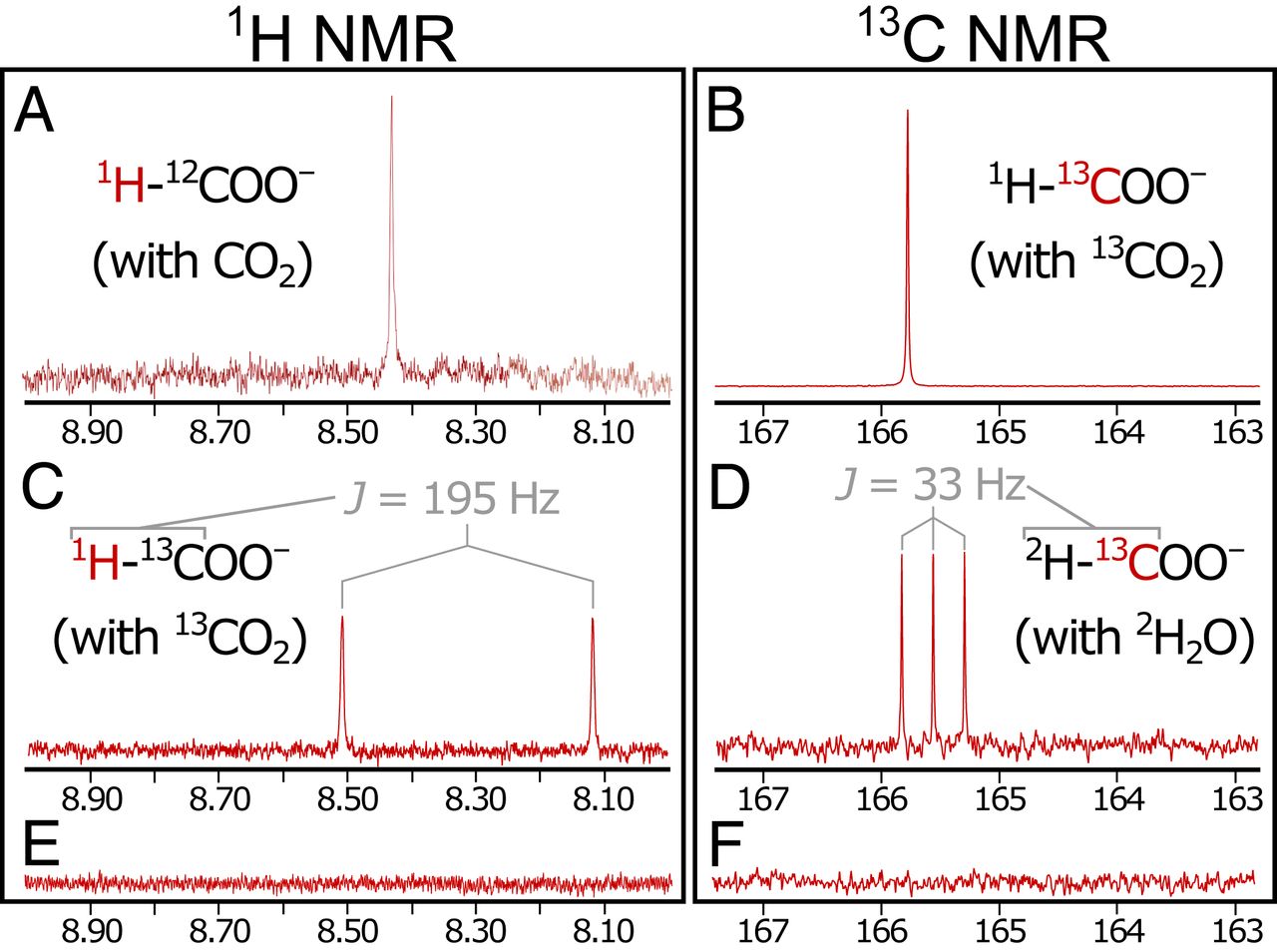
Image # 2
Pics singulets dans les spectres RMN 1 H (8,42 ppm; 2A ) et 13La RMN C (165,8 ppm) correspond à des échantillons d'acide formique pur (> 98%). La réalisation des étapes de précipitation et de réaction avec du 13CO 2 enrichi isotopiquement (99% 13 C) (expérience 2) a donné un singulet plus fort dans le spectre 13 C (165,8 ppm; 2B ) et la division attendue du singulet formyle en un doublet (un signal divisé en deux pics) en spectre 1 H (J = 195 Hz) dû à l'interaction de 1 H - 13 C dans le groupe formyle ( 2C ). Il s'avère que H 2 est nécessaire pour réduire les émissions de CO 2 . Avec liquide côté sortie contrôlé par N 2 au lieu de H 2
( à savoir, en l'absence de H 2 pendant et après la précipitation), aucun produit de réduction ont été détectés (expérience 3, 2E et 2F ).
Pour une compréhension plus détaillée du processus en cours, des expériences supplémentaires sur le marquage avec du deutérium ( 2 H ou D) (expériences 4 et 5) ont été réalisées en utilisant des variantes isotopiques dans toutes les expériences.
Indépendamment du fait que le H 2 non étiqueté utilisé (expérience 1) ou D 2 (expérience 4) pour contrôler la pompe du côté du liquide alcalin n'a observé que du HCOO marqué non isotopique - une sortie de fluide. Cette observation suggère que la réduction du CO2 peut se produire exclusivement du côté de l'océan.
Inversement, avec D 2 O utilisé à la place du H 2 O habituel côté océan et avec H 2 non marqué entraînant une pompe côté liquide alcalin (Expérience 5), on a trouvé exclusivement du formiate deutéré (DCOO - ), comme en témoigne triplet à 13 C RMN (J = 33 Hz) et aucun autre pic notable ( 2D ). Cela confirme en outre que la réduction du CO 2 est cohérente avec la composition isotopique côté océan et non côté crustal.
À l'étape suivante de l'étude, le rôle du gradient de pH du système hydrothermal alcalin sous-marin simulé a été testé. Les réductions de CO 2 réussies indiquées dans le tableau 1 se sont produites à un pH analogique de l'océan 3,9 et à un pH analogique de rejet de 12,3.
Lors du mélange, ce ∆pH initial de 8,4 unités diminuerait inévitablement, mais les gradients de pH de plusieurs unités sont maintenus avec succès dans le temps sur des échelles microfluidiques, en particulier en présence de précipité à l'interface.
Il était nécessaire de comprendre si un tel gradient de pH dans le système de réduction est nécessaire pour faciliter l'oxydation de H 2 du côté alcalin et la réduction du CO 2 du côté acide ( 1A). Après sédimentation dans les mêmes conditions que pour l'expérience 1, les effets des différents niveaux de pH et de la composition de chacun des deux liquides ont été évalués (tableau n ° 2). Le remplacement de la source alcaline simulante par du H 2 O pur entraîné par H 2 était inefficace (tableau 2, expérience 6).
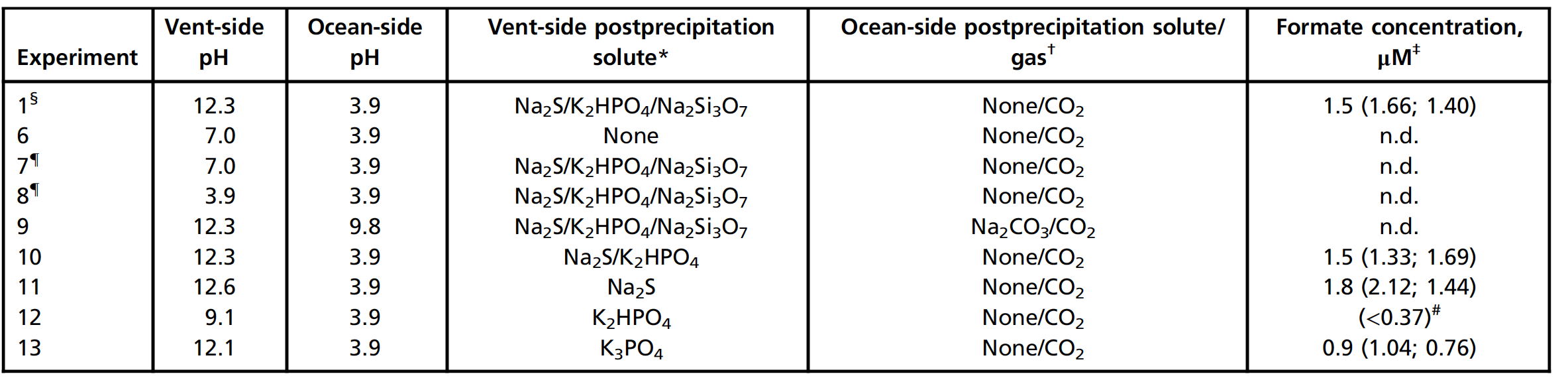
Tableau 2: résultats d'expériences avec différentes valeurs de pH.
De même, l'acidification du liquide analogue de source alcaline avec HCl à pH 3,9 et pH 7,0 n'a pas conduit à la formation de formiate (expériences 7 et 8).
Ajout de 100 mM de Na 2 CO 3 au fluide océanique tout en utilisant du CO 2en tant que gaz propulseur (expérience 9), le pH de l'océan a augmenté à 9,8 et aucun produit n'a été trouvé dans ces conditions. L' élimination du silicate à partir du côté de la source après la précipitation du formiate encore produit (expérience 10), de même que l' élimination du silicate et de phosphate avec seulement Na 2 S (Expérience 11).
Avec seulement K 2 HPO 4 après dépôt du côté de la source alcaline, seules des quantités résiduelles de formiate (inférieures à la limite de quantification de 0,37 μM) ont été détectées, probablement en raison d'un pH alcalin insuffisant de 9,1 (expérience 12). Le K 3 PO 4 plus alcalin , en revanche, a élevé le pH à 12,1 et conduit à la formation de formiate significativement plus (expérience 13).
Les scientifiques disent qu'ils ne peuvent pas complètement exclure la possibilité que le sulfure associé aux précipités agisse comme un agent réducteur en plus de H 2 . Cependant, les résultats ci-dessus confirment simultanément le rôle du gradient de pH et montrent qu'une alimentation continue en sulfure aqueux n'est pas nécessaire dans le système.
L'élimination du Ni du fluide sédimentaire océanique (expérience 14) n'a entraîné la formation que d'une petite quantité de formiate. À l'inverse, le remplacement du Fe pour laisser Ni comme seul métal dans le fluide sédimentaire océanique (NiCl 2 , 55 mM; expérience 15) a donné 1,4 μM de formiate, indiquant un rôle décisif pour Ni dans les précipitations.
Élimination de FeCl 2 et NiCl 2du fluide océanique, comme prévu, n'a pas conduit à la formation de formiate et de sédiments détectables (expérience 16).
Les scientifiques pensent que l'explication la plus appropriée de ce qui se passe est le processus électrochimique ( 1A ), mais il existe plusieurs mécanismes alternatifs pour réduire les émissions de CO 2 associées à l'oxydation de H 2 , qui sont moins probables.
L'un de ces mécanismes peut être appelé le plus «simple», mais aussi le moins biochimiquement homologue - la réduction du carbone due à l'hydrogénation directe ( 3A - 3C ). Dans ce cas, l'hydrogène de H 2 sera transféré directement au CO 2soit sous forme d'hydrogène atomique (hydrogénation classique), soit sous forme d'hydrure (hydrogénation ionique).
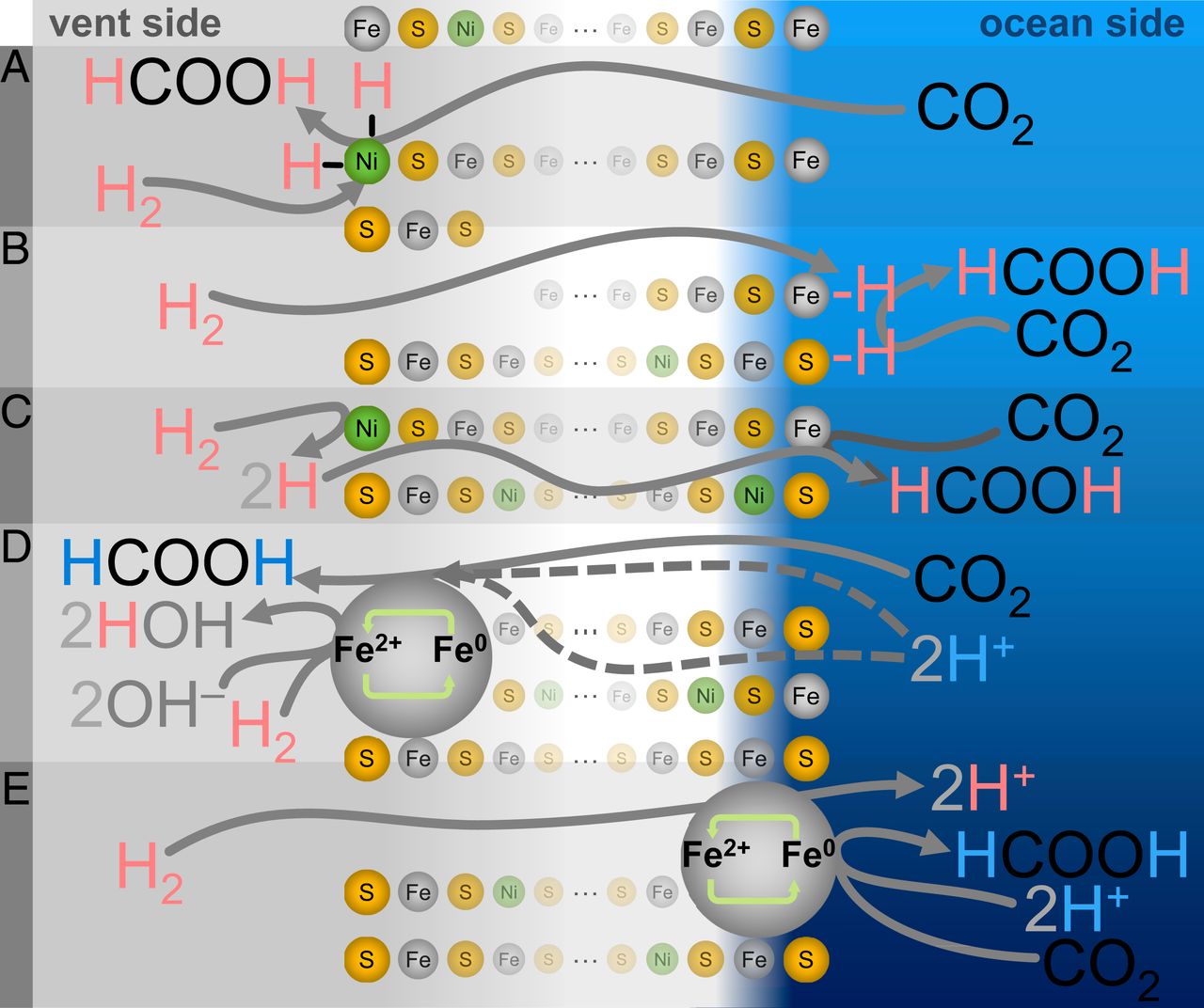
Image # 3
En d'autres termes, la sortie d'un tel mécanisme doit correspondre à la signature isotopique du gaz H 2 / D 2 libéré . Au lieu de cela, le formiate produit dans ce cas ne correspond qu'à la composition isotopique de l'eau côté océan, quelle que soit la composition du gaz ou de l'eau côté hydrothermal.
Dans les mécanismes d'hydrogénation directe, les particules d'hydrogène adsorbées peuvent échanger avec le liquide environnant, de sorte que la signature isotopique originale est perdue. Cependant, un tel processus implique la migration d'une quantité importante de liquide à travers le sédiment. Un mélange substantiel de liquides aurait dû provoquer un signal H / D mixte de formyle, qui n'a pas été observé dans les expériences pratiques, excluant complètement l'hydrogénation. Une
autre option possible est que les atomes d'hydrogène dans le formiate résultant peuvent ne pas provenir directement de H 2 . Au lieu de cela, le mécanisme peut être réalisé via le cycle redox de l'atome d'arête ou de coin Fe ou Ni (M 2+ ⇄ M 0 ), dans lequel le métal est d'abord réduit par H2 (laissant deux protons pour la dilution), puis le métal transfère les électrons acquis au CO 2 avec l'élimination des protons du milieu aqueux local ( 3C - 3E ).
Cependant, ce scénario est difficile à comparer avec les valeurs de pH réelles qui étaient au cours des expériences. Le pH de 3,9 a été atteint uniquement en dissolvant du CO 2 dans l'eau. Ainsi, tous les protons du côté de l'océan devraient se produire à la suite de la dissociation de l'acide carbonique par:
H 2 O + CO 2 ⇌ H 2 CO 3 ⇌ H + + HCO - 3
Lorsque la réaction a été effectuée en utilisant du D 2 O (expérience 5) comme solvant côté océan, seul le DCOO - a été trouvé dans le courant de sortie . Il s'ensuit que la réduction du CO 2 ne s'est pas produite du côté de la source où de l'eau ordinaire (H 2 O) et H 2 étaient présentes .
Il peut y avoir plusieurs scénarios pour un tel cycle redox localisé ( 3D et 3E ), mais comme ils nécessitent tous un placement conjoint, aucun d'entre eux ne peut offrir une signature isotopique exclusivement côté océan, ce qui a été observé lors des expériences.
Combinés à la forte dépendance au pH de la réaction, ces résultats suggèrent que la réduction du CO 2 se produit via un mécanisme électrochimique, dans lequel les électrons de l'oxydation de H 2 du côté de la source alcaline se déplacent à travers les précipitations de Fe (Ni) S vers le CO 2 du côté de l'océan. ( 1A ).
Les processus ci-dessus n'auraient pas pu se produire s'il n'y avait pas de mécanisme pour activer et maintenir l'interaction entre l'eau de mer et les évents hydrothermaux alcalins. De plus, la question se pose de la «vitalité» des composés organiques formés, car ils pourraient simplement se dissoudre dans l'eau de l'océan avant de jouer un rôle biochimique.
La réponse à la première question peut être l'effet Venturi * causé par l'augmentation de la porosité de la structure des évents hydrothermaux. Une fois à l'intérieur de l'évent, le dioxyde de carbone océanique peut réagir avec les électrons transportés à travers les minéraux catalytiques du canal d'évent hydrothermal, et de nouveaux sédiments peuvent également se produire plus loin dans le temps lorsque les deux liquides entrent en contact.
L'effet Venturi * est la perte de charge lorsqu'un flux de liquide ou de gaz traverse une partie rétrécie d'un tuyau.La modélisation de cette théorie a montré que dans le cas d'un réacteur expérimental de 300 μm de large, il se produit effectivement une fusion microfluidique de deux réactifs, ce qui a été montré dans des expériences pratiques.
Les scientifiques notent également que cet effet ne se limite pas aux évents alcalins sous-marins et est susceptible de se produire dans les systèmes hydrothermaux poreux n'importe où et à n'importe quelle profondeur, ce qui permet une variété de scénarios géochimiques pour l'origine de la vie.
Il est à noter que le système microfluidique de réduction du CO 2 à l' aide de H 2 n'est pas le seul. Il existe également une technique dans laquelle un système périodique à un seul canal est utilisé.
Autres minéraux (Fe 3 Ni), pression plus élevée (10 bar pour H2 ) et à des températures plus élevées (100 ° C) que dans les expériences réalisées, le système batch permet d'obtenir beaucoup plus de formiate, ainsi que plusieurs produits de réduction supplémentaire (acétate, méthanol et pyruvate). De plus, le taux de production de formiate (5,21 x 10 -9 mol / s) est de quatre ordres de grandeur plus élevé que le taux atteint par le système microfluidique.
L'importance du système périodique réside dans le fait que ses résultats confirment les performances du système microfluidique. Ceci confirme la théorie concernant l'existence de matière organique dans les conditions d'évents hydrothermaux alcalins anoxiques.
Pour une connaissance plus détaillée des nuances de l'étude, je recommande de consulter le rapport des scientifiques etdes matériaux supplémentaires .
Épilogue
Tout ce qui a un début a une fin. Ces mots, prononcés par la Pythie du film "Matrix", dans une interprétation ou une autre, ont été prononcés par de vrais philosophes et scientifiques bien avant la sortie de ce film. De plus, l'un des principes fondamentaux de la science est rappelé du cours de chimie scolaire - rien ne disparaît nulle part et n'est pris de nulle part sans laisser de trace. Avec ce qui se passera à la fin, ou plutôt après, l'humanité devra y faire face pendant très longtemps. Mais il y a déjà une certaine compréhension de ce qui était au début.
Dans cette étude, les scientifiques ont décrit une variante possible de la formation des premiers composés organiques. Selon eux, ce processus s'est déroulé à la jonction des eaux océaniques et des sources hydrothermales. Au cours des expériences, il a été possible de convertir le CO 2 en molécules organiques au moyen de H 2et pH contrôlé.
Ce résultat explique non seulement les origines de la vie sur notre planète, mais peut également être utilisé dans le développement d'instruments de réduction des émissions de CO 2 , qui est un problème très pénible du monde moderne. Entre autres, comprendre comment la matière organique est apparue sur Terre nous permet de construire des théories plus rentables sur la présence possible de celle-ci sur d'autres planètes comme la nôtre.
Si nous passons à une vague plus philosophique, alors nous pouvons dire avec confiance que ce travail démontre l'importance de comprendre le passé pour la formation réussie de l'avenir. L'histoire regorge de recherches, que les contemporains appelaient une vaine curiosité et une perte de temps. La grande majorité d'entre eux s'est avérée être beaucoup plus importante que quiconque ne l'aurait deviné. La conclusion est simple: en science, vous devez chercher des réponses à toutes les questions, aussi ridicules qu'elles puissent paraître à première vue.
Merci pour votre attention, restez curieux et passez une bonne semaine de travail, les gars. :)
Un peu de publicité
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir du contenu plus intéressant? Soutenez-nous en passant une commande ou en recommandant à des amis, Cloud VPS pour les développeurs à partir de 4,99 $ , un analogue unique des serveurs d'entrée de gamme que nous avons inventé pour vous: The Whole Truth About VPS (KVM) E5-2697 v3 (6 Cores) 10 Go DDR4 480 Go SSD 1Gbps à partir de 19 $ ou comment diviser correctement le serveur? (options disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
Le Dell R730xd 2x est-il moins cher dans le centre de données Equinix Tier IV à Amsterdam? Seulement, nous avons 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2,6 GHz 14C 64 Go DDR4 4x960 Go SSD 1 Gbps 100 TV à partir de 199 $ aux Pays-Bas!Dell R420 - 2 x E5-2430 2,2 GHz 6C 128 Go DDR3 2 x 960 Go SSD 1 Gbps 100 To - À partir de 99 $! Lisez à propos de Comment construire l'infrastructure de bldg. classe avec les serveurs Dell R730xd E5-2650 v4 au coût de 9000 euros pour un sou?