
Si la biologie vous intéresse, surtout si vous enseignez ce sujet, alors mon article sur la préparation et la conduite de travaux de laboratoire pour identifier un gène génétiquement étranger dans l'ADN des aliments vous sera utile.
La polémique autour des OGM, ainsi que les discussions scientifiques et éthiques incessantes sur la légalité de l'intervention humaine dans les «affaires de la Nature / Dieu», seront laissées aux philosophes. Nous affirmons seulement que la compétence professionnelle d'un biologiste, biotechnologiste, bioinformatique et génétique moderne est inconcevable sans la capacité de rechercher et, si nécessaire, de modifier les gènes. Déjà à l'école, et plus tard à l'université, les expériences et expériences biotechnologiques exigent que les élèves et les étudiants définissent des tâches claires, comprennent la méthodologie de l'expérience et la capacité d'analyser les données. Tout cela développe la curiosité et la confiance, et crée une base pour une étude plus approfondie des questions et des problèmes associés à la recherche scientifique. Mon PLAN-CONSPECTbasé sur 3 tests réalisés avec des réactifs BioRad et un équipement standard requis pour les analyses PCR. Mais, bien sûr, tout autre KIT peut être utilisé pour détecter les OGM. Toutes les nuances de l'expérience (protocoles) sont détaillées dans la documentation accompagnant les réactifs, je ne m'attarderai donc pas sur eux en détail. Ainsi, le plan d'ensemble porte 2 noms: PLAN - parce qu'il est nécessaire de planifier clairement et minutieusement le contenu de la leçon, et CONSPECTER - parce qu'il est nécessaire de réfléchir à l'avance sur le matériel à enseigner aux enfants et sur quoi se concentrer afin de révéler pleinement le but de l'expérience.
Plan
L'expérience est conçue pour deux sessions.
Leçon 1:
1. Familiarisation théorique des étudiants avec les bases de la stratégie de détection des OGM (cibles de détection et d'identification).
2. Isolement de l'ADN des aliments (un écolier ou un élève apporte tout produit de son choix).
3. Réalisation de la réaction en chaîne par polymérase.
Deuxième leçon:
4. Electrophorèse sur gel et discussion.
5. Remarques finales de l'enseignant.
Abstrait
Première leçon
1. D'où viennent les nouveaux gènes et les éléments auxiliaires (15-20 minutes)
Les organismes génétiquement modifiés sont des organismes qui ont une combinaison étrangère de matériel génétique obtenu à l'aide de la biotechnologie moderne. Par exemple, en utilisant des plasmides Ti, des gènes étrangers et des caractéristiques de plantes génétiquement modifiées peuvent être des gènes qui fournissent une résistance aux herbicides (cp4, epsps, gox), une résistance aux ravageurs (cry) ou des gènes qui modifient la qualité du produit (PG, Bay TE). Pour l'expression d'un gène étranger dans une cellule hôte, des éléments génétiques supplémentaires sont nécessaires:
- promoteur - une séquence nucléotidique qui est reconnue par l'ARN polymérase comme marqueur de l'initiation de la transcription;
- – , - ;
- - – ( ), ;
- – , , .
La conception du plasmide contient également un gène chloroplaste hautement conservé du photosystème II - une partie de la réaction lumineuse de la photosynthèse pour confirmer que l'ADN viable a été extrait et qu'un résultat GM négatif n'est pas associé à une matrice non viable.
L'identification de l'ADN recombinant dans les aliments peut se faire de plusieurs manières, comme le montre la figure 1.

Figure 1. Identification de l'ADN recombinant dans les aliments
Les kits de réactifs prêts à l'emploi les plus courants utilisés pour identifier les produits OGM sont basés sur l'identification d'un promoteur et d'un terminateur. Le kit GMO Investigator de BioRad utilise la PCR et l'électrophorèse d'ADN pour vérifier la présence de deux séquences d'ADN différentes associées aux OGM: le promoteur 35S du virus de la mosaïque du chou-fleur et le terminateur du gène de la nopaline synthase d'Agrobacterium tumefaciens. Ces séquences d'ADN se trouvent dans> 85% des plantes génétiquement modifiées commercialisées dans le monde. Le nouveau gène présent dans l'ADN du contrôle positif est l'epsps. En tant que contrôle de l'intégrité de l'ADN végétal extrait des aliments, la PCR est utilisée pour amplifier une partie du gène chloroplaste du photosystème II qui est commun à la plupart des plantes supérieures. Ainsi, le test cible 3 cibles: un promoteur,terminateur et une partie du gène chloroplaste du photosystème II, respectivement, dans un ensemble de 3 amorces, dont deux (amorces du promoteur et du terminateur) ont été mélangées. Par conséquent, il y a 2 flacons dans l'ensemble: rouge - amorces OGM, utilisées pour déterminer si l'aliment contient des OGM, et vert - plante photosystème II, utilisé pour déterminer si l'ADN a été extrait de matériel végétal.
Après le discours d'introduction, les étudiants doivent se familiariser avec le protocole d'extraction d'ADN et de PCR, expliquer étape par étape le déroulement de l'expérience et se concentrer sur les caractéristiques de travail avec un KIT d'un fabricant particulier.
2. Isolement de l'ADN des aliments (15 à 20 minutes)
En fonction des emplois disponibles, les enfants peuvent être divisés en groupes de 2-3 personnes, chacun choisit un produit alimentaire intéressant à analyser. Les chips ou le maïs soufflé, si appréciés des écoliers, sont les bienvenus comme matériel de recherche, car presque toutes les pommes de terre et le maïs à partir desquels sont fabriqués des friandises croustillantes portent des gènes étrangers et il est très facile d'y identifier les OGM. Ou des baies, par exemple, des fraises, des myrtilles, du pain aux graines de tournesol. Mais il est conseillé de convenir à l'avance qui testera quel produit, car les KIT d'extraction d'ADN sont conçus pour certains produits et, par exemple, celui utilisé dans ce cas n'implique pas l'isolement de l'ADN de la farine, de l'huile, des assaisonnements, des flocons de maïs, etc.
Dans les expériences que j'ai décrites, l'ADN a été isolé de myrtilles, de concombres et de graines de tournesol.
Caractéristiques distinctives de cette étude:
- Pré-pesée de l'échantillon (1 g) et broyage complet avec un mortier. Le broyage est nécessaire pour détruire les parois cellulaires plutôt denses des plantes (que les cellules animales n'ont pas).
- Isolement avec une InstaGene Matrix homogénéisée (bien que bien sûr un détergent puisse être utilisé) sans ajout de protéases (destruction des protéines cellulaires) et sans précipitation d'ADN avec des sels, puisque le sel est déjà dans InstaGene.
- Il n'y a pas de sorbant dans KIT, par conséquent, sans élution - en principe, les enfants ne peuvent pas y prêter attention.
Pourquoi InstaGene Matrix a-t-il été utilisé en principe? Parce que c'est un moyen assez rapide d'isoler l'ADN - en 15-20 minutes, ce qui permet de gagner beaucoup de temps en classe. InstaGene chélate également les ions divalents (par exemple Mg2), qui sont nécessaires pour les enzymes qui détruisent l'ADN (par exemple la DNase).
3. Réalisation de la réaction en chaîne par polymérase
Après l'isolement réussi de l'ADN des aliments par les enfants, selon les protocoles du fabricant, des mélanges PCR sont préparés pour 6 tubes Eppendorf selon le tableau 1 (10-15 minutes).

Lien
Après cela, la première partie de l'expérience se termine. L'enseignant place lui-même les tubes dans l'amplificateur et règle les modes d'amplification selon le protocole.
Deuxième leçon
4. Electrophorèse sur gel et discussion (40-45 minutes) Les
enfants préparent un gel d'agarose à 3% dans du tampon TAE. Alors que l'électrophorèse dure (200 V 20 minutes), vous pouvez discuter des options probables pour les résultats (Figure 2). Et après avoir reçu les photos, discutez des erreurs possibles.

Figure 2. Résultats de test possibles
Référence
Par exemple, dans le groupe d'enfants qui ont testé les concombres, aucun amplicons n'a été observé (Figure 3).

Figure 3. Image sur gel d'un échantillon d'électrophorèse (concombre)
⁕ - témoins (- ne contenant pas d'OGM, + contenant des OGM); T - échantillon d'essai; M - marqueur de poids moléculaire; PMM - apprêt photosystème II; L'OGM est une introduction aux OGM.
Discussion sur les résultats d'un échantillon:dans ce cas, aucune amorce n'a été ajoutée au mélange d'amplification.
La deuxième expérience consiste à tester l'ADN des graines de tournesol (Figure 4).
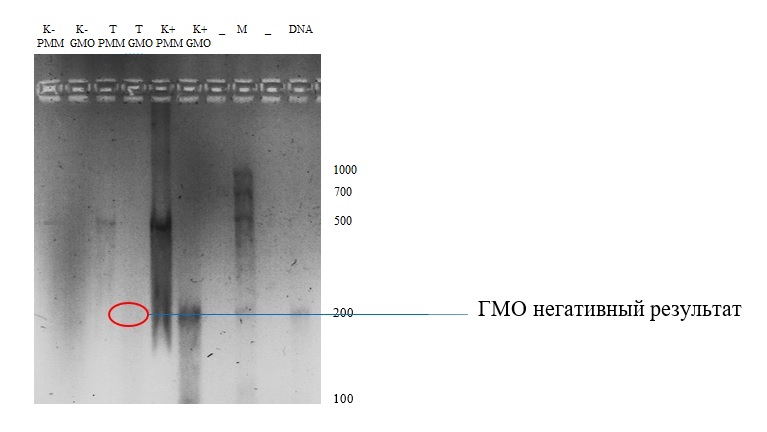
Figure 4. Image gel de l'électrophorèse, échantillon de graines de tournesol
⁕ - témoins (- ne contient pas d'OGM, + contient d'OGM); T - échantillon d'essai; M - marqueur de poids moléculaire; PMM - apprêt photosystème II; L'OGM est une introduction aux OGM.
Discussion sur les résultats du 2ème échantillon:le témoin négatif (poche de gel 2), dans le génome dont il n'y avait pas de gènes modifiés, ne contient pas d'amplicons. Cela indique que l'amorce n'a pas reconnu la région de séquençage du promoteur 35S et du terminateur NOS. Le schéma inverse avec la détection d'un amplicon d'environ 200 paires de bases a été observé dans la 6ème poche de gel (contrôle positif - contrôle génétiquement modifié). Visuellement, un seul produit d'amplification d'une longueur d'environ 200 pb a été obtenu dans le contrôle positif GMO (poche de gel 6), mais les produits d'amplification du promoteur et du terminateur étaient presque de la même taille (203 pb et 225 pb, respectivement (BioRad)), donc que l'on peut supposer qu'il y a deux produits d'amplification dans la poche de gel 6.Dans la plupart des études, le promoteur 35S et le terminateur NOS sont les plus couramment utilisés et peuvent être utilisés pour détecter des gènes modifiés dans plus de 85% des cas. Cette méthode est suffisante pour répondre à la question de savoir si le promoteur et / ou le terminateur ci-dessus était présent, mais cette méthode ne suffit pas pour répondre aux gènes insérés.
Des amplicons spécifiques du gène chloroplaste du photosystème II peuvent être trouvés dans les 3 échantillons alimentaires (poches 1, 3, 5), à la fois ceux contenant des gènes modifiés et ceux qui ne contiennent pas de gènes modifiés. Les échantillons étudiés ne contenaient pas les amplicons du terminateur NOS ou du promoteur 35S (poche 4). Malgré le fait que l'expérience a été menée avec succès et que les étudiants ont obtenu un résultat sans ambiguïté, la photo n'est pas tout à fait claire, comme si elle était nuageuse. Etant donné que ce phénomène s'est étendu à l'ensemble du gel, on peut conclure qu'une contamination s'est produite lors de la préparation du tampon 1x TAE. C'était probablement de la verrerie contaminée dans le laboratoire.
La dernière expérience teste les myrtilles (Figure 5).

Figure 5. Électrophorèse sur gel d'un échantillon de myrtille
⁕ - contrôles (- ne contient pas d'OGM, + contient des OGM); T - échantillon d'essai; M - marqueur de poids moléculaire; PMM - apprêt photosystème II; L'OGM est une introduction aux OGM.
Discussion sur les résultats de 3 échantillons: après exécution du gel, le gel d'agarose est vu de haut en bas. Les 3 échantillons alimentaires contiennent des amplicons caractéristiques du gène chloroplaste du photosystème II. Une bande peut être vue dans le contrôle négatif (avec des amorces OGM), puisqu'il s'agit d'un contrôle génétiquement libre, c'est très étrange. Aucun amplicons d'environ 200 paires de bases n'était attendu. Bande de 200 pb apparaît également dans l'échantillon de test (myrtille) et dans le contrôle positif. Cela indique que l'amorce a reconnu le site de séquençage du promoteur 35S du terminateur NOS.
Mais pourquoi le test d'un échantillon de myrtilles s'est avéré positif (génétiquement modifié), cela peut être dû au fait que les myrtilles sont une espèce végétale transgénique naturelle.
L'échantillon à l'étude est probablement un exemple d'interférence d'un organisme avec un autre organisme utilisant des bactéries du sol (tumefaciens). Un tel exemple de transfert transgénique naturel dans les bleuets a déjà été identifié par Tatyana Matveeva, docteur en sciences biologiques, professeur à l'Institut de génétique et de biotechnologie, Faculté de biologie, Université d'État de Saint-Pétersbourg. Elle et ses collègues de l'institut ont compilé un catalogue mondial de plantes avec des génomes déjà séquencés. Sur les 275 espèces végétales étudiées, 23 étaient des transgènes naturels. Y compris le cultivar d'arachide, le cultivar de noix, le houblon, les fruits de goyave tropicale, les clous de girofle, les cerises du Surinam, les canneberges et les myrtilles. (Matveeva, 2019).
Par conséquent, on suppose que la myrtille étudiée est un transgène naturel.
5. 2
Il semble que la réalisation de la PCR est simple, mais le dépannage peut être plus difficile si l'amplicon souhaité n'est pas obtenu ou si des fragments non spécifiques apparaissent. Le plus souvent, nous parlons de verrerie contaminée en laboratoire. Pour éviter la contamination des réactifs et des approches PCR, il faut veiller à utiliser des pointes de pipette neuves pour chaque processus de pipetage. De plus, il est judicieux de changer de gants plus souvent pendant que vous travaillez. De plus, des récipients et des solutions de réaction neufs et stérilisés doivent toujours être utilisés et correctement étiquetés pour suivre clairement la contamination. Il peut y avoir de nombreuses raisons pour lesquelles la PCR ne fonctionne pas. Divers paramètres chimiques et physiques doivent être respectés pour une PCR réussie. Malheureusement, il arrive très souvent qu'après la PCR, il ne soit pas possible d'obtenir les résultats souhaités.
Etant donné que même les plus petites quantités d'ADN peuvent être détectées par PCR, il est extrêmement important d'éviter la contamination des mélanges réactionnels de PCR avec des produits de PCR provenant d'expériences précédentes ou un «ADN étranger» provenant d'autres sources.
Résultat
L'expérience de la détection des OGM dans les aliments vise à acquérir des compétences pratiques dans la réalisation de la réaction en chaîne par polymérase. Malgré le fait qu'un plan de synthèse soit proposé, conçu pour 2 leçons, dont l'intervalle est d'au moins un jour, le scénario typique reste à la discrétion de l'enseignant. Les sections analytiques de cette étude sont conçues pour guider les apprenants tout au long du processus de découverte et de compréhension des concepts pertinents pour les procédures et l'analyse des données à chaque étape du voyage. On espère que cette approche (par rapport au fait que l'enseignant donne aux étudiants toutes les informations de base) rendra l'ensemble de l'étude plus compréhensible pour un plus grand nombre d'étudiants. Tant que l'enseignant a la possibilité de vérifier les progrès et le niveau de compréhension de chaque groupe (pendant 2 leçons),un certain degré d'indépendance est possible si on le souhaite. Cette approche permet à davantage d'apprenants d'acquérir les compétences souhaitées telles que définies ci-dessus.
Liste de la littérature utilisée:
- bio-rad, «www.bio-rad.com», 3 février 2020. [En ligne]
- Matveeva T., Ottem L. (2019). Occurrence généralisée de transformation génétique naturelle des plantes par Agrobacterium. Plant Molecular Biology, 101, 415-437. DOI: 10.1007 / s11103-019-00913-y